近日,iHuman研究所安德烈·萨利课题组在Nature Communications发表了题为“In situ structure of actin remodeling during glucose-stimulated insulin secretion using cryo-electron tomography”的研究论文,利用超分辨率荧光成像和冷冻电子断层扫描技术,结合量化分析,深入探讨了葡萄糖刺激下胰岛素分泌(Glucose stimulated insulin secretion, GSIS)过程中肌动蛋白丝的重塑现象。这项研究为肌动蛋白丝在胰岛素释放过程中的结构性重塑提供了直接的原位证据。

肌动蛋白丝是细胞骨架的关键组成部分,在细胞的结构维持、迁移、分裂以及对线粒体、溶酶体和胰岛素分泌颗粒等亚细胞结构的运动控制中也扮演了重要角色。肌动蛋白丝的重塑通过Rho GTPase和PI3K/Akt的相关细胞信号通路触发。在胰岛β细胞中,肌动蛋白丝在GSIS过程中起着双重作用,不仅调节胰岛素分泌颗粒(ISGs)的运输和释放,还在细胞膜附近由“障碍物”转变为“助推器”。尽管早期的二维成像技术已捕捉到肌动蛋白丝重塑的轮廓,荧光成像和蛋白质免疫印迹(western blot)技术也揭示了肌动蛋白丝的解聚和重聚过程,但对肌动蛋白丝在重塑前后的纳米级结构仍知之甚少。此外,对于胰岛素分泌颗粒在GSIS过程中的运动至关重要的肌动蛋白丝、微管以及ISGs之间相互作用的确切结构细节也尚未完全明了。
这项研究利用多模态成像技术深入探索了INS-1E β细胞在静息状态(2.8 Glu – 30 min)及GSIS的初期和后期阶段中肌动蛋白丝的重塑。结果显示,在高浓度葡萄糖刺激下的最初5分钟内(16.7 Glu – 5 min),细胞外围的肌动蛋白丝几乎完全解聚,而在30分钟后(16.7 Glu – 30 min),这些肌动蛋白又重新聚合形成丝状结构。值得注意的是,与细胞底膜(VM)准垂直(45-90°)排列的肌动蛋白丝在重塑后的数量明显增加,从饥饿状态的3%增加到16.7 Glu – 30 min条件下的15%(图1)。
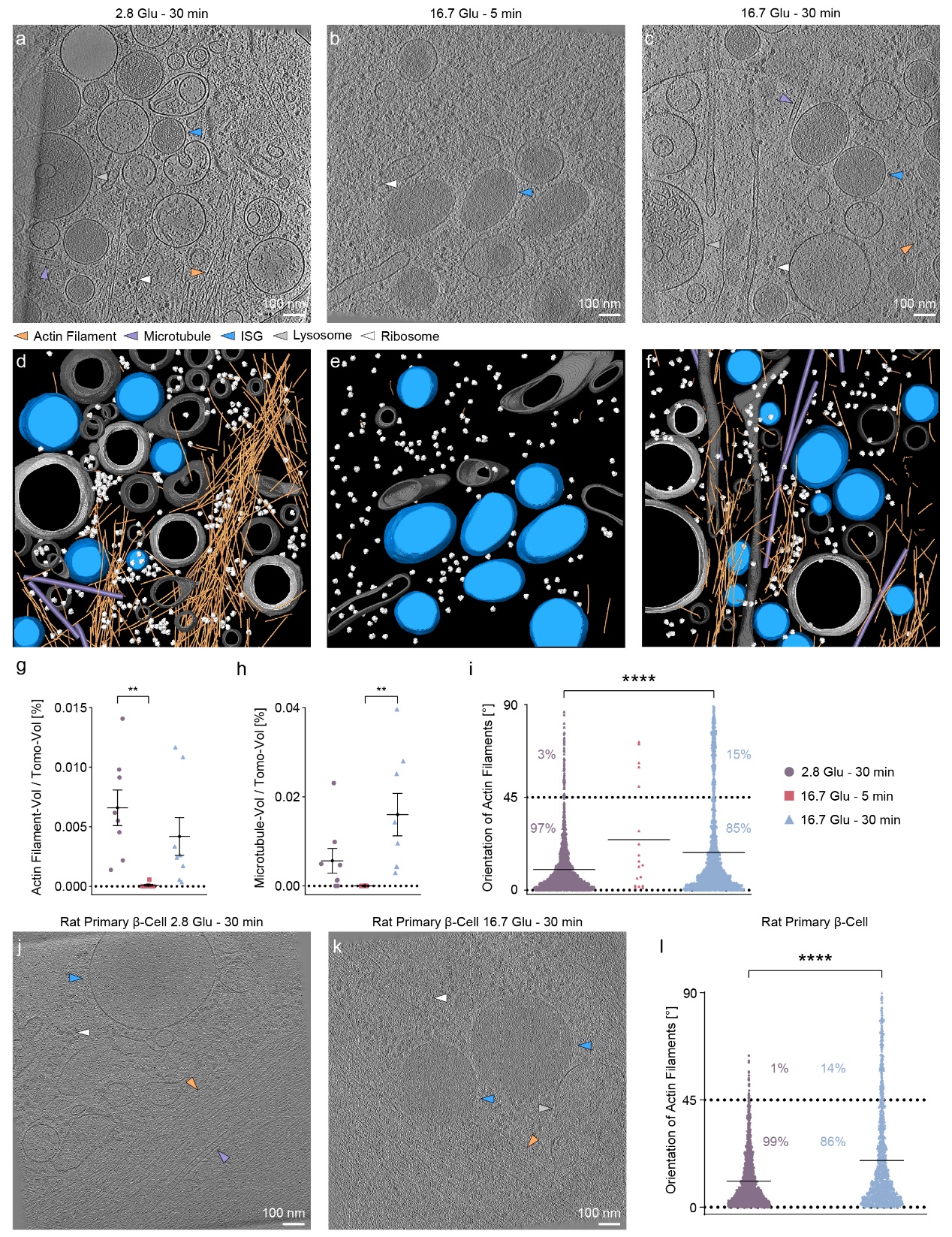
图1. 细胞外围的肌动蛋白丝和微管在GSIS 中的定量分析
通过对INS-1E β细胞外围的冷冻电镜成像,研究团队观察到肌动蛋白丝网络在重塑期间的结构变化。尽管肌动蛋白丝的总体积并未显著改变,且大部分肌动蛋白丝以0-15°的角度形成束状结构以维持细胞结构。然而,与饥饿条件相比,在16.7 Glu - 30 min条件下,肌动蛋白丝束的数量有所减少;与VM准垂直的肌动蛋白丝间距显著增大。此外,在使用粘着斑激酶抑制剂Y15处理的INS-1E β细胞中,肌动蛋白丝重塑后,与VM成0-15°角度排列的肌动蛋白丝量显著减少,而大于45°角度的肌动蛋白丝量增加(图2)。值得注意的是,Y15处理消除了重塑前后肌动蛋白丝角度的变化,这表明粘着斑复合体在肌动蛋白角度变化中起着促进作用,且这种变化对胰岛素在β细胞中的分泌具有重要的生理意义。此外,在重塑后,与VM准垂直排列的肌动蛋白丝与彼此平行,形成了一种从VM锚点放射出的“blooming”结构,这种结构的形成可能是为了促进亚细胞成分,尤其是ISGs,从细胞外围运输到VM并最终释放。
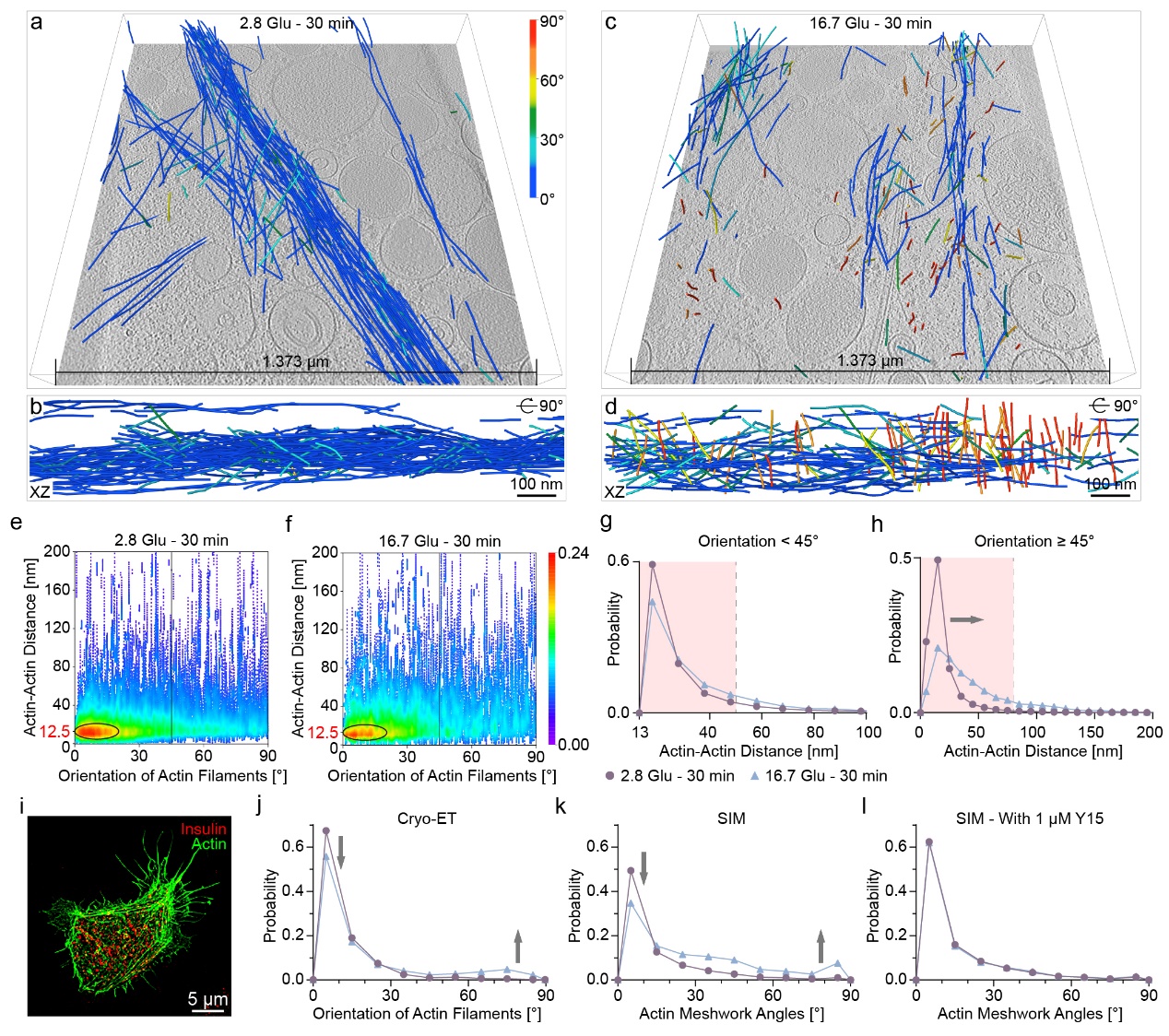
图2. 细胞外围肌动蛋白丝的定量分析
先前的研究已经证明,肌动蛋白丝能够通过与微管的相互作用来促进胰岛素的分泌。具体来说,ISGs首先沿微管从细胞内部向细胞外围移动,随后通过肌动蛋白丝从细胞外围进一步运输至底膜。在对细胞外围进行的冷冻电镜成像中,研究团队发现一些ISGs位于肌动蛋白丝和微管的附近。在16.7 Glu – 30 min条件下,靠近重新排列的肌动蛋白丝的ISGs数量有所增加,表明这一过程可能与ISGs的运输过程密切相关。通过进一步定量分析了ISGs与肌动蛋白丝及微管之间的最短距离,结果表明,与饥饿条件相比,在16.7 Glu - 30 min条件下ISGs与肌动蛋白丝之间的距离有所拉近,说明在重塑后肌动蛋白丝与ISGs之间的空间布局发生了变化,从而有利于ISGs的进一步运输和释放。此外,基于荧光显微镜的观察结果表明,微管在饥饿条件下通过限制ISGs的运动来负面调控胰岛素的分泌。通过计算微管与ISGs之间的距离,本研究提供了微管在饥饿条件下对ISGs释放进行负面调控的纳米级结构信息。最后,通过计算每根肌动蛋白丝与最近微管之间的距离,结果显示,在16.7 Glu - 30 min条件下,无论是与底膜平行还是准垂直的肌动蛋白丝都更接近微管。总体而言,无论是与底膜平行还是准垂直的肌动蛋白丝,在16.7 Glu - 30 min条件下都比在饥饿条件时更接近微管。
本研究捕捉了胰岛β细胞外周和内部纳米尺度上的肌动蛋白丝重塑结构并进行定量分析,包括GSIS期间肌动蛋白丝网络结构的变化、肌动蛋白丝的排列以及肌动蛋白丝、微管和ISGs之间的相互作用。这些分析有助于更好地理解肌动蛋白丝重塑及其在调控胰岛β细胞双相胰岛素分泌中的作用(图3)。
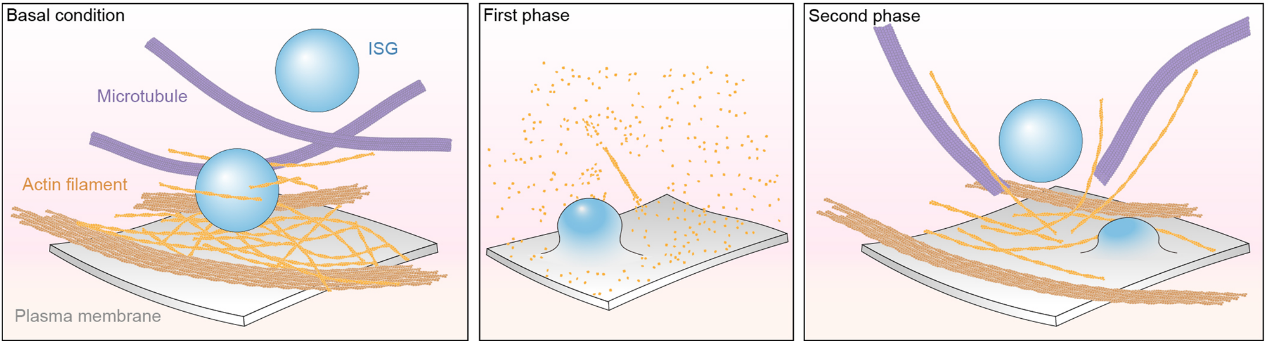
图3. GSIS 期间细胞外围肌动蛋白丝重塑模型示意图
9499威尼斯官网登录生命学院2020级博士研究生李伟民为该论文的第一作者。9499威尼斯官网登录iHuman研究所副研究员孙立萍,德国Helmholtz Pioneer Campus教授Marion Jasnin,美国University of California, San Francisco教授安德烈·萨利和德国Max Planck Institute of Biochemistry教授Wolfgang Baumeister为共同通讯作者。Kate L. White教授、Raymond C. Stevens教授均为本研究合作者。9499威尼斯官网登录为第一完成单位。


 沪公网安备
沪公网安备 